福建脂质体载药核酸
脂质体核酸疫苗核酸***剂是一类新兴的药物,显示出***各种疾病的潜力。然而,由于核酸是多价阴离子和高度亲水分子,它们几乎不被细胞吸收。它们也很容易被血液中的核酸酶降解。因此,它们需要一种传递载体才能进入细胞并发挥作用。LNP载体是核酸类药物的成功载体之一。核酸药物Patisiran(ONPATTRO)是一种在LNPs中配方的siRNA,用于减少肝脏中甲状腺素转运蛋白的形成,**近获得FDA批准用于***遗传性甲状腺素转运介导的淀粉样变性。它是**早获批的siRNA药物,也是**早的lnp配方核酸药物,标志着核酸***学发展的一个重要里程碑。COVID-19mRNA疫苗中的LNPs。LNPs的***成功应用是辉瑞/BioNTech和莫当纳**近批准的两种COVID-19信使RNA(mRNA)疫苗的递送载体,这两种疫苗的开发速度****,在疾病预防方面显示出显着的效果。疫苗将编码SARS-CoV-2刺突蛋白的mRNA送入宿主细胞细胞质;mRNA被翻译成刺突蛋白,刺突蛋白作为抗原,导致对病毒产生免疫反应。两种mRNA疫苗的脂质纳米颗粒的组成非常相似。脂质体的粒径和粒径分布的检测。福建脂质体载药核酸

4PEG2000在脂质体中的作用
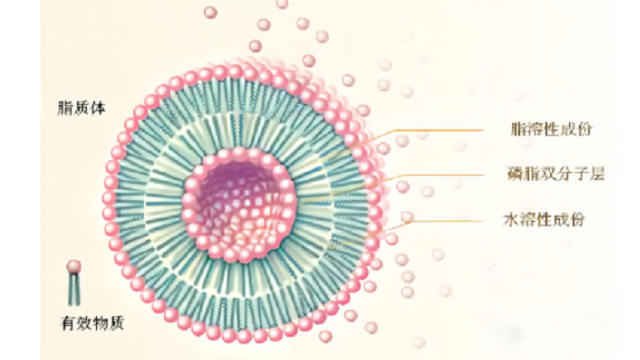
PEG2000是一种聚乙二醇(PEG)衍生物,常用于脂质体的表面修饰。它在脂质体中具有多种作用:1.稳定性增强:PEG2000可以在脂质体表面形成一层稳定的水合层,防止脂质体的聚集和沉淀,从而提高其在溶液中的稳定性。2.血液循环延长:脂质体表面修饰PEG2000可以降低脂质体被吞噬的速度,延长其在血液循环中的半衰期,从而增加药物的生物利用度。3.免疫原性降低:PEG2000可以掩盖脂质体表面的亲水性基团,减少脂质体与免疫系统的识别和***,降低免疫原性,提高脂质体的生物相容性。4.药物释放调控:PEG2000修饰的脂质体可以通过改变PEG链的长度和密度来调控药物的释放速率和方式,实现对药物的精确控制释放。在Doxil和Onivyde中,甲氧基peg(Mw2000Da)与DSPE(MPEG-DSPE)共价结合,提供了“隐形”和空间稳定的脂质体。PEG的分⼦量和PEG-DSPE在脂质组成中的摩尔百分⽐对双层填料、循环时间和热⼒学稳定性有重要影响。⾼分⼦量的PEG(>2000Da)移植到脂质头群上,表现出来⾃脂质体表⾯的排斥⼒,并保护脂质体不与⾎清蛋⽩结合,避免被单核吞噬系统(MPS)进⼀步***,但也减少了靶细胞对脂质体的相互作⽤和内吞作⽤。 脂质体载药外壳脂质体是由多种组分构成的,主要包括:磷脂质、胆固醇、表面活性剂和PEG2000等。
酸性环境(pH值2.0-4.0)通常⽤于产⽣⽤于活***物装载的跨膜pH梯度。在37℃和pH2.0条件下,SM/Chol脂质体(55/45,mol/mol)的⽔解速率⽐DSPC/Chol脂质体慢约100倍。此外,含有SM/Chol的脂质体表现出比较好的药代动⼒学特性,即增加循环时间并增强药物向靶组织的递送。胆固醇(Chol)是脂质体双分⼦层的另⼀个主要成分,⼏乎可以⽤于所有的商业产品。Chol的加⼊可以促进脂链的堆积和双分⼦层的形成,调节膜的流动性/刚性,并进⼀步影响药物释放、脂质体的稳定性和胞外分泌动⼒学。对于Shingrix(带状疱疹疫苗,含有糖蛋⽩E抗原和AS01B脂质体佐剂系统)的产物,Chol可以避免QS21(AS01B佐剂系统中的免疫增强剂之⼀)以2:1的⽐例(Chol:QS21,w/w)⽔解。对于AmBisome的产物,与⾮甾醇相⽐,Chol降低了脂质体制剂的毒性。Chol对双分⼦层性质的影响是浓度依赖性的。据报道,低浓度(2.5mol%)和⾼浓度(>30mol%)的Chol对脂质双分⼦层的性质影响不⼤。5<Cholmol%<30的Chol的“冷凝效应”或“有序效应”导致颗粒⼤⼩从220nm逐渐增⼤到472nm,膜的流动性降低,药物释放减少。除了Chol,其他与Chol结构相似的甾醇,如⻩体酮、⻨⻆甾醇和⽺⽑甾醇,也被研究⽤于调节膜的刚性和稳定性。
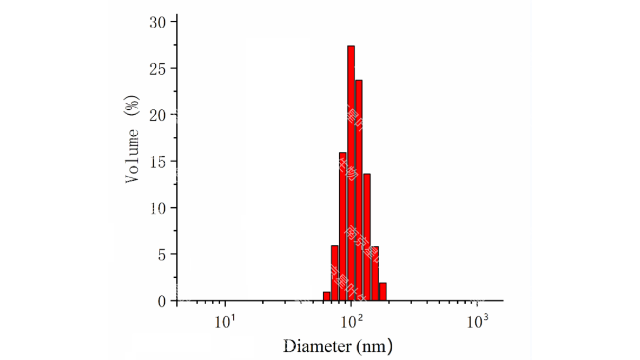
商业脂质体产品,包括Visudyne和AmBisome,使⽤这种⽅法制造。MLV悬浮液在⾼压下通过⼀个狭窄的间隙,通过剪切⼒、湍流和速度梯度产⽣的流体空化⽽被分解,然后重新排列成更⼩的脂质体。颗粒⼤⼩和粒度分布由均质过程的参数决定,如压⼒、处理周期、阀⻔和冲击设计、流速等;它们还受到样品性质的影响,包括散装介质的组成和粘度以及颗粒的初始尺⼨分布。不断增加的压⼒和处理循环会降低颗粒尺⼨和多分散性指数(PDI),但也会导致封装效率降低。脂质体核酸疫苗的稳定性和储存条件。
3脂质体中的相变温度
脂质体中的相变温度是指脂质双分子层中脂质分子从一个状态转变为另一个状态所需的温度。这个温度对于脂质体的性质和功能具有重要作用:1.药物释放控制:脂质体在体内可以通过温度变化来控制药物的释放。例如,如果脂质体的相变温度在人体温度范围内,那么在注射进体内后,脂质体可能会在特定温度下释放药物,这可以用于设计温敏***物输送系统。2.稳定性:相变温度也可以影响脂质体的稳定性。在相变温度以下,脂质体可能会形成固态结构,增加了其稳定性,而在相变温度以上,脂质体可能会转变为液态,导致结构松散和药物释放。3.生物相容性:脂质体的相变温度应当与生物体的温度相匹配,以确保脂质体的生物相容性。如果相变温度太高或太低,可能会对组织或细胞产生不良影响。负载药物的选择:相变温度也可能影响到可负载在脂质体中的药物类型。一些药物可能会干扰脂质体的相变温度,而另一些药物则可能受到相变温度的影响,导致在特定温度下释放。表明脂质体双分⼦层在体温中处于⽆序和药物“漏出”状态。综上所述,脂质体中的相变温度对于药物输送系统的设计和性能调控非常重要,可以影响药物的释放速率、稳定性和生物相容性。 脂质体的靶向释放对吸收、分布和消除等各种药动学参数的影响。中国台湾脂质体载药mRNA
相变温度对脂质体的影响。福建脂质体载药核酸
脂质体各组分对核酸递送效率的影响对于使用阳离子脂质体开发核酸***剂,一个先决条件是必须将核酸适当地递送到靶细胞并到达适当的亚细胞区室(例如,细胞质或细胞核)。已知阳离子脂质体的递送效率会受到阳离子脂质和辅助脂质类型及其组成的影响。阳离子脂质是纳米粒子的**成分,具有一个带正电的头基和一个或两个由碳氢链或类固醇结构组成的疏水尾区的共同结构。Felgner和同事报道了N-[1-(2,3-二聚氧基)丙基]-N,N,N-三甲基氯化铵(DOTAP)的合成,其具有一个单价阳离子头和两个碳氢化合物尾部,并用于制备小的单层脂质体。他们将DNA包裹的脂质体转染到小鼠L细胞中,并证明阳离子脂质中和了带负电荷的DNA,使阳离子脂质体有更好的机会与带负电荷的细胞膜相互作用。从那时起,各种阳离子脂质和基于脂质的纳米颗粒被设计和评估用于核酸的细胞递送,包括DNA,siRNA,miRNA和AS-ODN。这些新的阳离子脂质已经通过文库技术和基于理性的预测相结合的方法被鉴定出来。对类脂类材料文库的筛选产生了由十个碳和两个烷基链组成的阳离子脂质,发现其比其他候选物更有效。
福建脂质体载药核酸











