宿迁多重免疫组化分析
免疫组化实验中,优化抗原修复选择策略简述:首先,依据抗原理化性质和位置(细胞质、膜、核)选择修复方法。其次,初步试验确定是否需修复。细胞质抗原倾向温和修复;细胞膜抗原可能需较强修复;细胞核抗原则需准确修复。特殊抗原依据文献指导。优化修复条件,调整pH、温度、时间。设置对照,包括阴性、阳性及修复条件对照,确保结果准确性。进行预实验,对比不同修复条件下染色效果。考虑组织和固定因素对修复方法的影响。综上,合理选择修复方法需准确考虑抗原特性、实验条件,通过系统性测试优化。对比常规染色,免疫组化提供更精确的组织病理学信息,助力疾病诊断。宿迁多重免疫组化分析
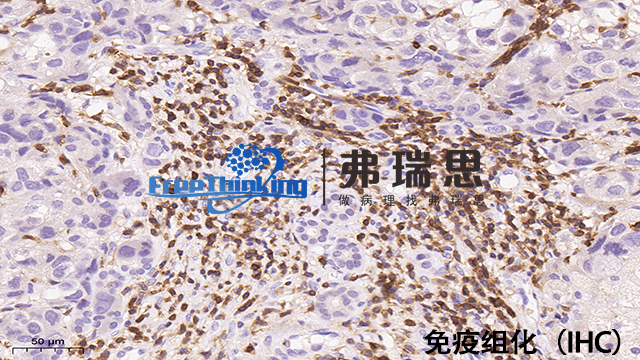
保存和运输免疫组化样本的关键点:1、快速固定(<20分钟)于适量(样本体积20倍)固定液中。2、使用适宜固定剂(如10%中性福尔马林),掌握合适固定时间(6-24小时)。3、固定后室温稳定至少两天,冰冻样本-80℃保存,运输时用干冰或冰袋维持低温。4、完整标注样本信息,确保记录无误。5、选平底容器防损。6、定期更换固定液。7、运输时密封防污染损坏。8、石蜡包埋前完成脱水、透明步骤。9、建议备份样本。10、遵守相关法规和生物安全标准。合理措施确保样本质量与实验准确性。梅州免疫组化扫描使用哪种成像技术能有效提高免疫组化图像的分辨率?
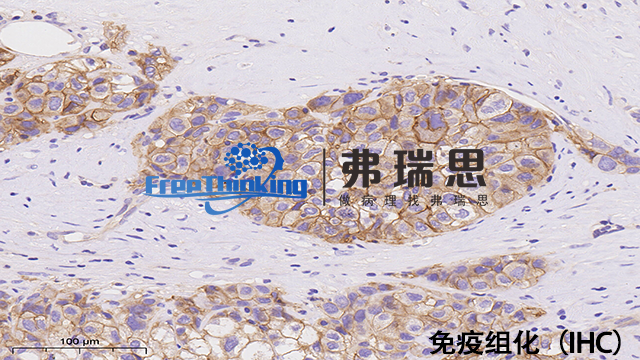
荧光共定位研究的免疫组化实验宜选择荧光标记抗体而非酶标记法。具体的关键策略有以下几点:1、直接法使用荧光一抗,简化步骤但成本高选择少;2、间接法采用未标记一抗+荧光二抗,灵活性高,利于多目标区分;3、多色荧光染色,结合多波长二抗实现复杂共定位分析;4、考虑量子点,因亮度高、光稳定、光谱窄,减少光谱重叠。选择荧光染料时,须确保光谱兼容性,避免信号混淆,并注意荧光淬灭问题,优化实验设计以减轻自发荧光和光淬灭影响。
免疫组化技术在基因表达调控研究中扮演着至关重要的角色,在基因表达调控研究中,免疫组化技术的主要作用体现在以下几个方面:1、定位分析:通过特定的抗体,免疫组化技术可以精确地定位到细胞或组织中特定蛋白质的分布情况,从而了解相关基因的表达位置和表达水平。2、表达模式研究:通过比较不同条件下(如正常与病变组织、不同发育阶段等)蛋白质的表达情况,免疫组化技术可以帮助研究者揭示基因表达的变化规律,进而理解基因表达的调控机制。3、功能研究:通过免疫组化技术检测特定蛋白质的表达和定位,研究者可以推断这些蛋白质在细胞或组织中的功能,进而推测相关基因的功能。4、与分子生物学技术的结合:免疫组化技术可以与其他分子生物学技术(如PCR、基因芯片等)相结合,从多个角度研究基因表达调控,提供更准确、深入的信息。免疫组化的应用有那些?
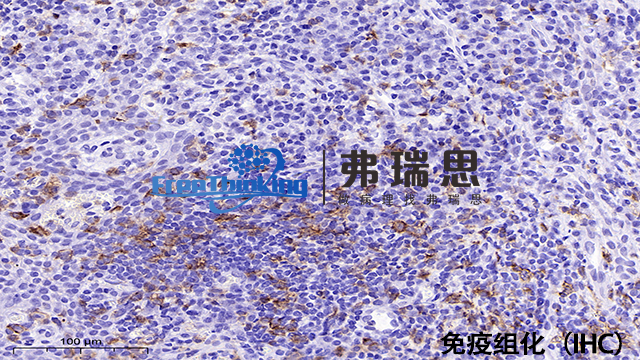
在免疫组化实验中,切片厚度对实验结果具有明显影响,主要体现在以下几个方面:1、抗原暴露与检测:较薄的切片能够更好地展示组织结构的细节,并有助于抗原的充分暴露。这有利于抗体与抗原的充分结合,从而提高检测的灵敏度和准确性。例如,对于淋巴结、肾等组织,切片厚度通常不超过3μm,以确保抗原的充分暴露。2、观察效果:切片过厚会导致细胞重叠,影响显微镜下的观察效果。细胞重叠会掩盖某些细节,使结果分析变得困难。同时,过厚的切片还可能导致脱片现象,进一步影响实验结果的可靠性。3、试剂渗透性:较薄的切片有利于试剂的渗透,使得抗体、显色剂等试剂能够更快地到达抗原所在位置,提高反应效率。相反,过厚的切片会阻碍试剂的渗透,导致反应不充分或结果不准确。4、实验效率:在相同条件下,较薄的切片更容易被染色和观察,从而提高实验效率。同时,薄切片所需的试剂量也相对较少,有助于降低实验成本。免疫组化实验中的切片厚度对实验结果具有重要影响。根据组织类型和实验需求选择合适的切片厚度至关重要。一般来说,对于需要较高灵敏度和准确性的实验,应选择较薄的切片;而对于需要展示组织结构细节的实验,可适当增加切片厚度。免疫组化的操作步骤有哪些?东莞病理切片免疫组化
免疫组化结合图像分析软件,量化数据处理,科学评估结果。宿迁多重免疫组化分析
进行多重免疫组化时,为了确保结果准确需避免抗体交叉反应,策略如下:1、选用高特异性抗体,查验证明资料。2、使用不同物种一抗,配对特异性二抗减风险。3、优化抗体浓度和孵育条件,避免非特异性结合。4、利用TSA等技术,清洗步骤中减少交叉反应。5、挑选光谱分离的荧光染料,防信号干扰。6、强化洗涤步骤,去除非结合抗体。7、应用阻断剂预防非特异性结合。8、设立阴/阳性对照,验证特异性。9、有序进行染色,必要时淬灭前一信号。宿迁多重免疫组化分析
上一篇: 韶关免疫组化分析
下一篇: 韶关切片病理染色原理